Hyperbarická léčba kyslíkem u dlouhodobého onemocnění koronavirem-19: případová zpráva
Pozadí
Pandemie koronavirového onemocnění 2019 (COVID-19) má za následek rostoucí populaci jedinců, kteří po vyléčení z akutního onemocnění pociťují širokou škálu dlouhodobých příznaků, označovaných několika termíny, včetně „stav po COVID“ a „dlouhé COVID." Pěti nejčastějšími příznaky, které byly po COVID rozpoznány, jsou únava (58 %), bolest hlavy (44 %), kognitivní porucha (27 %), vypadávání vlasů (25 %) a dušnost (24 %) [1]. V patogenezi dlouhého COVID hrají roli dva hlavní biologické následky COVID-19. První je hyperkoagulační stav charakterizovaný zvýšeným rizikem uzávěru malých a velkých cév [2]. Druhá je nekontrolovaná kontinuální zánětlivá reakce [3]. Mikroinfarkty a neuroinfammace jsou důležitými příčinami mozkové hypoxie a mohou být zodpovědné za chronický neustupující neurokognitivní pokles u pacientů s dlouhodobým onemocněním COVID [4]. Jednou z možností, jak zvrátit hypoxii, snížit neuroinfamacii a vyvolat neuroplasticitu, je hyperbarická oxygenoterapie (HBOT) [5].
V tomto článku uvádíme první kazuistiku dříve zdravého, sportujícího jedince, který trpěl dlouhodobým post-COVID syndromem úspěšně léčeným HBOT.
Případová prezentace
55letý dříve zdravý bělošský muž trpící přetrvávajícími neustupujícími příznaky dlouhodobého onemocnění COVID navštívil naši kliniku k vyhodnocení. Klinické projevy zahrnovaly problémy s pamětí, zhoršení multitaskingových schopností, únavu, nízkou energii, dušnost a sníženou fyzickou únavu, což vše začalo po akutní infekci SARS-CoV-2 diagnostikované před 3 měsíci. Původně se u něj dne 21. ledna 2021 vyvinula vysoká horečka bez bolesti na hrudi, kašle nebo dušnosti. Dne 30. ledna 2021 byl přijat do nemocnice kvůli dehydrataci a byl mu diagnostikován COVID-19 pomocí polymerázové řetězové reakce s reverzní transkripcí ( RT-PCR). Během pobytu v nemocnici se u něj rozvinul akutní respirační syndrom v důsledku pneumonitidy a vyžadoval podpůrnou léčbu vysokoprůtokovým kyslíkem po dobu 1 týdne. Z nemocnice byl propuštěn 16. února 2021. Při propuštění byl stabilizovaný s normálním kyslíkem a při fyzikálním vyšetření nebyly zaznamenány žádné neurologické nedostatky. Navíc 6 týdnů po diagnóze COVID-19 se u něj objevila plicní embolie a byl léčen rivaroxabanem. Před infekcí SARS-CoV-2 byl zdravým, vysoce funkčním a atletickým jedincem.
Základní hodnocení provedené na naší klinice, 3 měsíce po akutní infekci, zahrnovalo zobrazování magnetickou rezonancí mozku (MRI) s perfuzním a difuzním tenzorovým zobrazením (DTI), počítačové neurokognitivní hodnocení, kardiopulmonální zátěžový test (CPET) a testy plicních funkcí. .
Na začátku si pacient stěžoval na dušnost při cvičení a také na potíže s pamětí a multitaskingem, které začaly po jeho onemocnění COVID-19.
Fyzikální a neurologické vyšetření bylo normální. Vyhodnocení MRI mozku prokázalo sníženou perfuzi, která korelovala s poklesem kognitivních funkcí, jak je podrobně popsáno níže. Byl odeslán na hyperbarickou oxygenoterapii (HBOT), která zahrnovala 60 sezení, 5 dní v týdnu. Každé sezení zahrnovalo vystavení 90 minutám 100% kyslíku při absolutním tlaku 2 atmosféry s 5minutovými přestávkami každých 20 minut.
Pacient zahájil svou první HBOT 19. dubna 2021 a skončil 15. července 2021 bez jakýchkoliv významných vedlejších účinků. Po prvních pěti sezeních uvedl, že se jeho dýchání začalo zlepšovat a že ho po cvičení již nebolely svaly. Po 15 sezeních zaznamenal menší únavu a zlepšení předchozí nízké energie. Po 20 sezeních si všiml, že jeho dechová a pohybová kapacita se vrátila na úroveň před infekcí SARS-CoV-2 a vrátil se na běžecké horské stezky. Navíc poznamenal, že jeho paměť a schopnost multitaskingu se vrátily na úroveň před COVID-19.
Základní MRI mozku před HBOT ukázala dvě malá ložiska změn signálu v pravé a levé parietální oblasti svědčící pro časné onemocnění malých cév. Kromě toho došlo ke globálnímu poklesu perfuze mozku. Jak je podrobně uvedeno na Obr. 1 a Tabulce 1, přehodnocení po HBOT (provedené 4 týdny po poslední HBOT, aby se zabránilo jakémukoli potenciálnímu přechodnému účinku) odhalilo významné zvýšení mozkové perfuze. V tabulkách 2 a 3 jsou uvedena zlepšení mikrostruktury mozku, jak bylo prokázáno pomocí MRI–DTI.
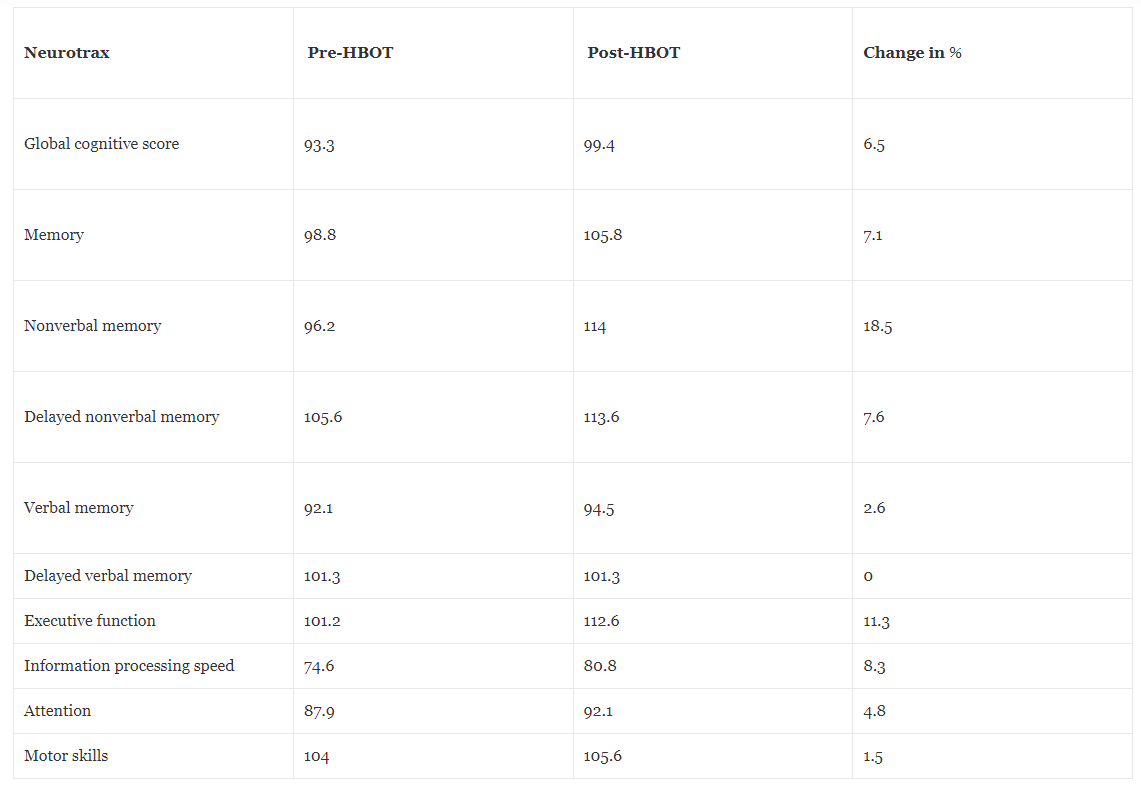
Před a po HBOT bylo provedeno neurokognitivní hodnocení pomocí plné počítačové testovací baterie NeuroTrax k měření různých aspektů mozkových funkcí, jako je paměť, rychlost zpracování informací, pozornost a výkonné funkce. Neurokognitivní testování po HBOT prokázalo významné zlepšení globální paměti s nejdominantnějším účinkem na neverbální paměť, exekutivní funkce, pozornost, rychlost zpracování informací, kognitivní flexibilitu a multitasking. Tabulka 4 shrnuje skóre před a po HBOT v různých kognitivních doménách.
Fyzická kapacita byla hodnocena testem maximální kardiopulmonální zátěže (CPET) prováděným na běžeckém pásu COSMED s použitím protokolu Boston 5. Tabulka 5 uvádí fyziologicky hodnocené parametry před a po HBOT. Jak je podrobně uvedeno, došlo k 34% nárůstu VO2 max z 3083 na 4130 ml za minutu po HBOT. Usilovaná vitální kapacita (FVC) se zlepšila o 44 % z 4.76 na 6.87 l, objem usilovného výdechu (FEV) o 23 % z 3.87 na 4.76 l a maximální měření přítoku (PEF) o 20.2 % z 10.17 na 12.22 l za sekundu .
Po obdržení úplných informací na konci hodnocení po HBOT pacient podepsal informovaný souhlas umožňující zveřejnění jeho lékařských informací.
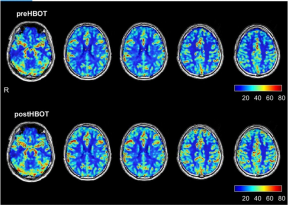
Obr. 1Perfuzní magnetická rezonance mozku před a po hyperbarické oxygenoterapii. Horní řada představuje perfuzi mozku 3 měsíce po akutní infekci, před hyperbarickou oxygenoterapií. Spodní řádek představuje zobrazení perfuzní magnetickou rezonancí provedené po dokončení protokolu hyperbarické oxygenoterapie.
Tabulka 1Změny průtoku krve v mozku před a po hyperbarické oxygenoterapii
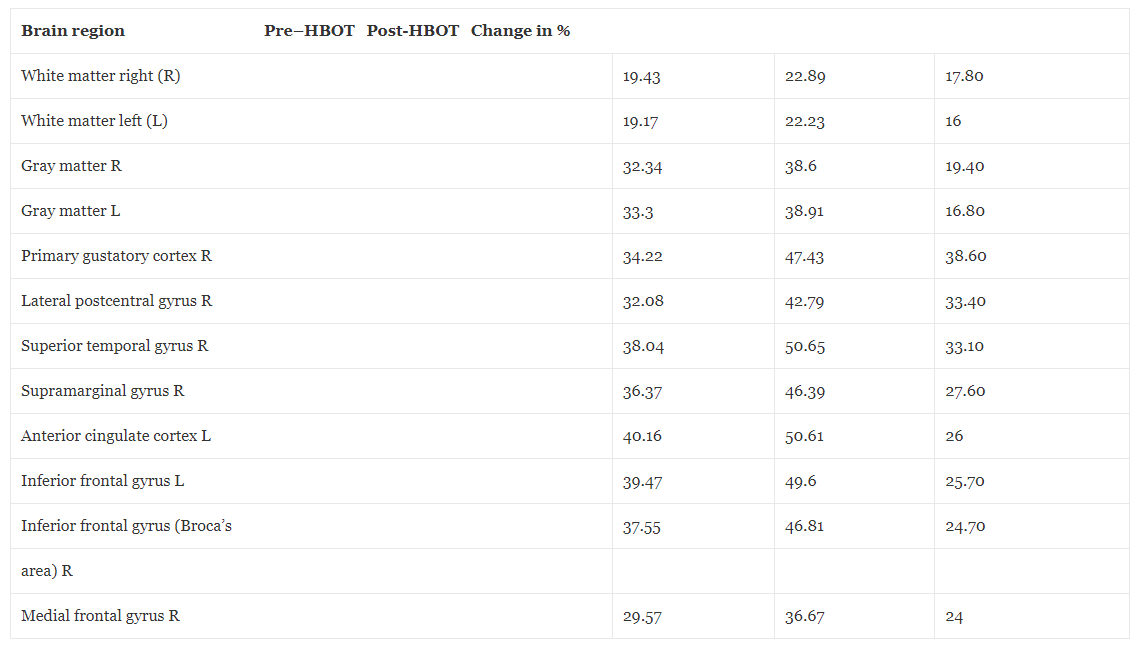
Diskuse a závěry
Zde uvádíme první případ pacienta s dlouhodobým COVID s kognitivními a kardiorespiračními příznaky úspěšně léčeného HBOT. Po léčbě prokázal významné zlepšení perfuze mozku, mikrostruktury bílé hmoty mozku a kognitivních a kardiopulmonálních funkcí. Tato kazuistika ukazuje, že HBOT má potenciální využití k léčbě pacientů s dlouhodobým onemocněním COVID, kteří trpí neustálým úpadkem kognitivních a fyzických funkcí.
Hypoxie hraje důležitou roli v patofyziologii dlouhého COVID. Systémová hypoxie může být důsledkem poškození plic a hypoxie související s orgány se může vyvinout v důsledku poškození cév. Přetrvávající funkce plic
Tabulka 2Zobrazování magnetickou rezonancí – difúzní zobrazování tenzorů frakční anizotropie před a po hyperbarické oxygenoterapii

Frakční anizotropie (FA) je míra používaná k hodnocení integrity vláken bílé hmoty, směrovosti a uspořádání. Vyšší hodnota FA ukazuje na lepší organizaci fber. DTI difúzní zobrazení tenzoru
Tabulka 3Zobrazování magnetickou rezonancí – difuzní zobrazení tenzorů střední změny difuzivity před a po hyperbarické oxygenoterapii
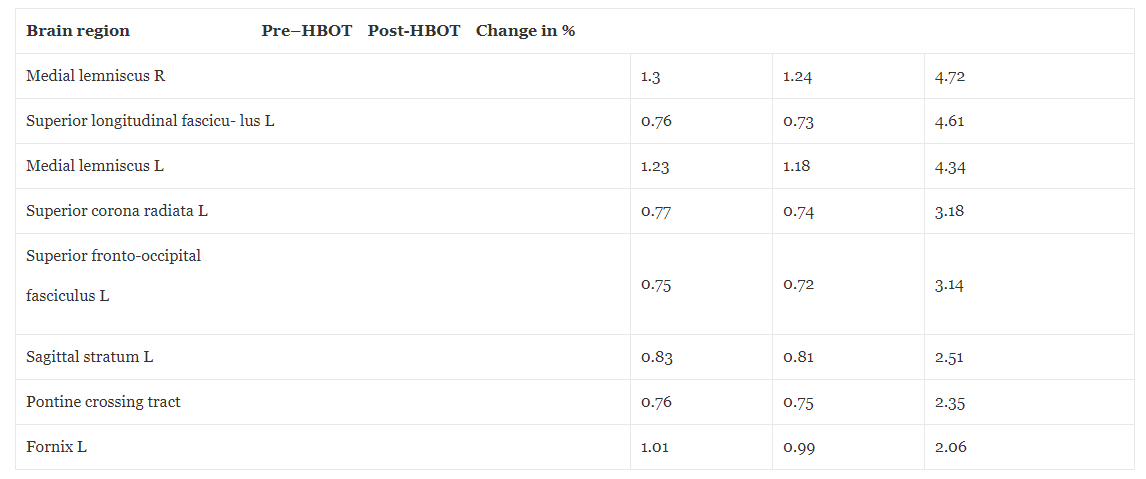
Střední difuzivita (MD) je míra používaná k hodnocení hustoty vláken bílé hmoty. Nižší hodnota MD znamená vyšší hustotu. DTI difúzní zobrazení tenzoru.
Tabulka 4Kognitivní skóre před a po hyperbarické oxygenoterapii
Tabulka 5Fyziologické parametry před a po hyperbarické oxygenoterapii
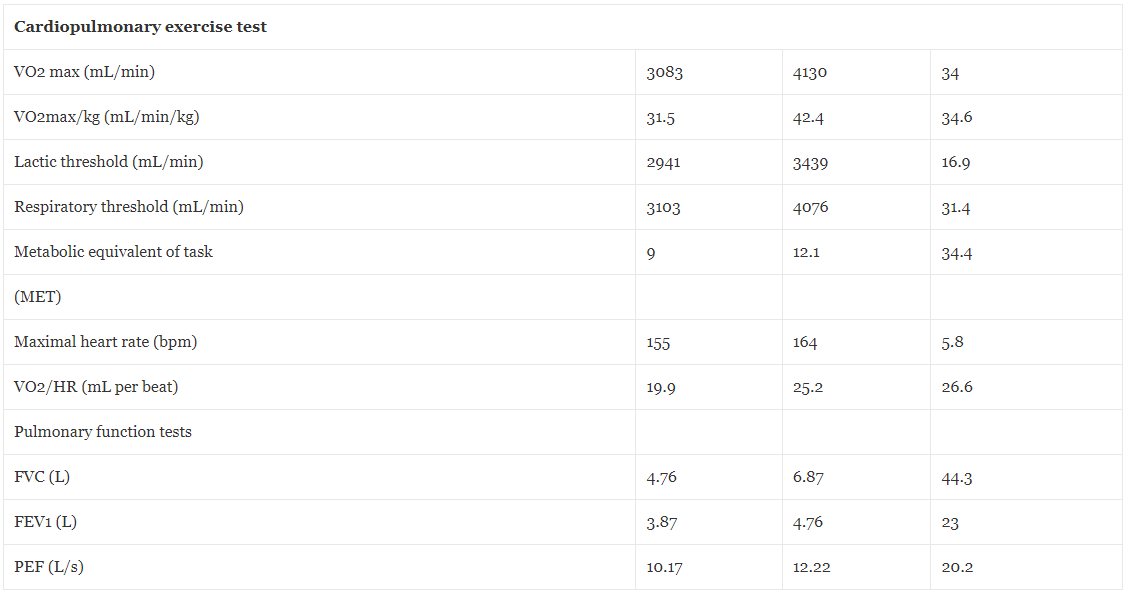
VO2max maximální rychlost kyslíku spotřebovaného během cvičení, ml/min mililitr za minutu, VO2max/kg maximální rychlost kyslíku spotřebovaného během cvičení na kilogram, ml/min/kg mililitrů za minutu na kilogram, MET metabolický ekvivalent úkolu, tepy za minutu za minutu , VO2/HR rychlost spotřebovaného kyslíku na srdeční frekvenci, FVC usilovná vitální kapacita, L litrů, FEV1 objem usilovného výdechu, měření PEF peak Fow, L/s litrů za sekundu.
poškození bylo pozorováno u pacientů, kteří během akutní infekce SARS-CoV-2 potřebovali doplňkový kyslík, dokonce i 6 a 12 měsíců po akutní infekci [6]. Vzhledem k tomu, že funkce mozku a regenerační kapacita jsou citlivé na jakýkoli pokles dodávky kyslíku [7], dlouhodobé kognitivní deficity korelují s množstvím kyslíku potřebného k překonání respiračních obtíží [1]. Co se týče ischemie související s orgány, COVID-19 indukoval poškození endotelu a hyperkoagulaci, což zvyšuje riziko vaskulární dysfunkce odpovědné za vysokou prevalenci infarktu myokardu, ischemických mrtvic a plicní embolie [8]. V prezentovaném případě pacient vyžadoval podpůrnou léčbu vysokoprůtokovým kyslíkem po dobu 1 týdne během akutního onemocnění, což znamená, že trpěl systémovou hypoxií s následným rizikem dlouhodobé kognitivní poruchy v důsledku anoxického poškození mozku. Navíc 6 týdnů po akutní infekci se u něj vyvinula plicní embolie, reprezentující endoteliální dysfunkci s další expozicí systémové hypoxii. Navíc, jak prokázala MRI perfuze mozku, měl mikrovaskulární perfuzní defekty, které korelovaly s jeho neurokognitivním poklesem.
HBOT zahrnuje inhalaci 100% kyslíku při tlacích přesahujících 1 atmosféru absolutní (ATA), čímž se zvyšuje množství kyslíku rozpuštěného v tělesných tkáních. I když mnohé z příznivých účinků HBOT lze vysvětlit zlepšením okysličení tkání, nyní se rozumí, že kombinované působení hyperoxie a hyperbarického tlaku spouští geny citlivé na kyslík i tlak, což má za následek indukci regeneračního procesy včetně proliferace a mobilizace kmenových buněk s antiapoptickými a protizánětlivými faktory, angiogeneze a neurogeneze [9–12]. HBOT může vyvolat neuroplasticitu a zlepšit kognitivní funkce i roky po akutním poškození [13]. V prezentovaném případě dlouhého COVID zlepšila HBOT cerebrální proudění krve do špatně prokrvených oblastí mozku (indikující mozkovou angiogenezi) a zlepšila integritu mozkové mikrostruktury (indikující neurogenezi). Korelace mezi významnými zlepšeními prokázanými při zobrazování mozku a neurokognitivními zlepšeními ukazuje, že většina příznivých účinků HBOT skutečně souvisí s její schopností vyvolat neuroplasticitu dysfunkčních oblastí mozku.
Bylo prokázáno, že HBOT má příznivé účinky na mitochondriální funkci, klíčový prvek vhodné svalové funkce [12]. HBOT může také zvýšit počet proliferujících a diferencujících satelitních buněk a také počet regenerovaných svalových vláken a podpořit svalovou sílu [14]. Bylo prokázáno, že nově intermitentní opakovaný protokol HBOT má potenciál zlepšit plicní funkce s ohledem na maximální výdechový proud (PEF) a silovou vitální kapacitu (FVC) [15]. U prezentovaného pacienta byla hodnocena výkonnostní kapacita kardiopulmonálního systému pomocí kardiopulmonálního zátěžového testu (CPET) a plicních funkčních testů. HBOT vyvolala významné zlepšení o 34 % v maximální kapacitě spotřeby kyslíku, zlepšení o 34.4 % v maximálních METs a zvýšení mléčného prahu o 16.9 %. Pokud jde o plicní funkce, FVC se zlepšila o 44.3 % a PEF o 20.2 %. Tato měřitelná zlepšení korelovala se schopností pacienta znovu získat předchozí vysoký sportovní výkon.
V tomto hlášeném případě byla HBOT zahájena více než 3 měsíce po akutní infekci SARS-CoV-2. I když symptomy přetrvávaly až do zahájení HBOT a výrazné zlepšení nastalo až po zahájení HBOT, je možné, že alespoň některé klinické zlepšení mohlo nastat bez HBOT. Náhlé výrazné zlepšení s úplným zotavením po chronické povaze příznaků, naše porozumění fyziologickým účinkům HBOT a objektivní měření provedená u tohoto pacienta však podporují vztah mezi léčbou a pozorovanými zlepšeními. Vzhledem k tomu, že se jedná pouze o kazuistiku, jsou zapotřebí další prospektivní klinické studie, aby bylo možné lépe porozumět potenciálním příznivým účinkům HBOOT na pacienty s dlouhodobým onemocněním COVID.
Stručně řečeno, tento článek představuje první případovou zprávu ukazující, že dlouhodobý COVID lze léčit pomocí HBOT. Příznivý účinek HBOT vrhá další světlo na patofyziologii tohoto syndromu. Vzhledem k tomu, že se jedná o jedinou kazuistiku, jsou potřebné další prospektivní randomizované kontrolní studie pro použití hyperbarické oxygenoterapie při léčbě dlouhodobého COVID.
Zkratky
HBOT: Hyperbarická oxygenoterapie; MRI: Zobrazování magnetickou rezonancí; DTI: Zobrazení tenzoru difúze; VO2 max: Maximální rychlost kyslíku spotřebovaného během cvičení; CPET: Kardiopulmonální zátěžový test; HR: srdeční frekvence; Bpm: srdeční tep za minutu; FVC: Vynucená vitální kapacita; FEV1: Objem nuceného výdechu; PEF: Peak Fow měření.
Poděkování
Neuplatňuje se.
Příspěvky autorů
AMB, ES, SE a SK analyzovaly a interpretovaly data pacienta týkající se MRI, perfuze a DTI. AMB a SE analyzovaly a interpretovaly data pacientů týkající se kardiopulmonálních a plicních funkčních testů. Všichni autoři přečetli a schválili konečný rukopis.
Příspěvky autorů
AMB, ES, SE a SK analyzovaly a interpretovaly data pacienta týkající se MRI, perfuze a DTI. AMB a SE analyzovaly a interpretovaly data pacientů týkající se kardiopulmonálních a plicních funkčních testů. Všichni autoři přečetli a schválili konečný rukopis.
Dostupnost údajů a materiálů
Všechna data vygenerovaná nebo analyzovaná během této studie jsou zahrnuta v tomto publikovaném článku.
Prohlášení
Etický souhlas a souhlas s účastí
Neuplatňuje se.
Souhlas se zveřejněním
Od pacienta byl získán písemný informovaný souhlas se zveřejněním této kazuistiky a všech doprovodných obrázků. Kopie písemného souhlasu je k dispozici ke kontrole šéfredaktorovi tohoto časopisu.
Konkurenční zájmy
AMB, ZW, SK, MG a UQ pracují pro kliniky AVIV. ES pracuje pro AVIV Scientifc LTD. SE je spoluzakladatelem a akcionářem společnosti AVIV Scientifc LTD.
Přijato: 11. října 2021 Přijato: 21. ledna 2022, Zveřejněno online: 15. února 2022
Reference
Lopez-Leon S, a kol. Více než 50 dlouhodobých účinků COVID-19: systematický přehled a metaanalýza. Sci Rep. 2021;11(1):16144.
LeviM a kol. Koagulační abnormality a trombóza u pacientů s COVID-19. Lancet Haematol. 2020;7(6):e438–40.
MahmudpourM, a kol. Cytokinová bouře COVID-19: hněv hanobení. Cytokin. 2020;133: 155151.
LiB a kol. Mozog-imunitní interakce u perinatálního hypoxicko-ischemického poškození mozku. Prog Neurobiol. 2017;159:50–68.
ShapiraR a kol. Hyperbarická oxygenoterapie zlepšuje patofyziologii myšího modelu 3xTg-AD zmírněním neuroinfammace. Neurobiol stárnutí. 2018;62:105–19.
HuangL a kol. 1leté výsledky u pacientů, kteří přežili nemocnici s COVID-19: longitudinální kohortová studie. Lanceta. 2021;398(10302):747–58.
HadannyA, Efrati S. Kyslík – limitující faktor pro obnovu mozku. Crit Care. 2015;19:307.
KatsoularisI a kol. Riziko akutního infarktu myokardu a ischemické cévní mozkové příhody po COVID-19 ve Švédsku: sebekontrolovaná série případů a odpovídající kohortová studie. Lanceta. 2021;398(10300):599–607.
Pena-Villalobosl a kol. Hyperbarický kyslík zvyšuje proliferaci kmenových buněk, angiogenezi a schopnost hojení ran WJ-MSC u diabetických myší. Přední Physiol. 2018;9:995.
CabigasBP a kol. Hyperoxická a hyperbarická kardioprotekce: role syntázy oxidu dusnatého 3. Cardiovasc Res. 2006;72(1):143–51.
GregorevicP, Lynch GS, Williams DA. Hyperbarický kyslík moduluje aktivitu antioxidačních enzymů v kosterních svalech potkanů. Eur J Appl Physiol. 2001;86(1):24–7.
ZhouZ a kol. Ochrana mitochondriální funkce a zlepšení kognitivní obnovy u potkanů léčených hyperbarickým kyslíkem po laterálním poranění poklepem. J Neurosurg. 2007;106(4):687–94.
HadannyA, a kol. Hyperbarická oxygenoterapie zlepšuje neurokognitivní funkce pacientů po cévní mozkové příhodě – retrospektivní analýza. Restor Neurol Neurosci. 2020;38(1):93–107.
HorieM a kol. Zlepšení diferenciace satelitních buněk a funkční zotavení poraněného kosterního svalu hyperbarickou kyslíkovou léčbou. J Appl Physiol. 2014;116(2):149–55.
HadannyA, a kol. Účinky hyperbarické oxygenoterapie na plicní funkce: prospektivní kohortová studie. BMC Pulm Med. 2019;19(1):148.
Poznámka vydavatele
Springer Nature zůstává neutrální, pokud jde o jurisdikční nároky v publikovaných mapách a institucionálních afilacích.






