Hiperbár oxigénkezelés hosszú ideig tartó koronavírus-betegség-19 esetén: esetjelentés
Háttér
A 2019-es koronavírus-betegség (COVID-19) világjárvány következtében egyre több olyan egyének populációját tapasztalják, akik az akut betegségből való felépülést követően hosszan tartó tünetek széles skáláját tapasztalják, amelyekre több kifejezés is utal, ideértve a „COVID utáni állapotokat” és a „hosszú ideig tartó állapotokat”. COVID." A COVID utáni öt leggyakoribb tünet a fáradtság (58%), a fejfájás (44%), a kognitív károsodás (27%), a hajhullás (25%) és a nehézlégzés (24%) [1]. A COVID-19 két fő biológiai következménye játszik szerepet a hosszú COVID patogenezisében. Te frst egy hiperkoagulálhatósági állapot, amelyet a kis- és nagyerek elzáródásának fokozott kockázata jellemez [2]. A második egy ellenőrizetlen, folyamatos gyulladásos válasz [3]. A mikroinfarktusok és az ideggyulladás fontos okai az agyi hypoxia kialakulásának, és felelősek lehetnek a hosszú COVID-ban szenvedő betegek krónikus, szüntelen neurokognitív hanyatlásáért [4]. A hipoxia visszafordításának, az ideggyulladás csökkentésének és a neuroplaszticitás kiváltásának egyik lehetősége a hiperbár oxigénterápia (HBOT) [5].
Ebben a cikkben bemutatjuk az első esetbeszámolót egy korábban egészséges, sportos egyénről, aki régóta fennálló COVID-t követő szindrómában szenvedett, és sikeresen kezelték HBOT-tal.
Esettanulmány
Egy 55 éves, korábban egészséges kaukázusi férfi, aki a COVID tartós, szűnni nem akaró tüneteitől szenvedett, jelentkezett klinikánkra értékelésre. A klinikai megnyilvánulások közé tartozott a memóriaproblémák, a többfeladatos képességek romlása, a fáradtság, az energiahiány, a légszomj és a csökkent fizikai állóképesség, amelyek a 2 hónappal korábban diagnosztizált akut SARS-CoV-3 fertőzés után kezdődtek. Kezdetben 21. január 2021-én magas fokú láza lett mellkasi fájdalom, köhögés vagy légszomj nélkül. 30. január 2021-án dehidráció miatt kórházba szállították, és reverz transzkripciós polimeráz láncreakcióval diagnosztizálták nála a COVID-19-et ( RT-PCR). Kórházi tartózkodása alatt tüdőgyulladás következtében akut légzőszervi szindróma alakult ki, és 1 hétig tartó szupportív kezelésre volt szüksége nagy áramlású oxigénnel. 16. február 2021-án hazaengedték a kórházból. Kibocsátásakor normális oxigénnel stabil volt, és a fizikális vizsgálat során nem észleltek neurológiai hiányosságot. Ezenkívül 6 héttel a COVID-19 diagnosztizálása után tüdőembólia alakult ki nála, és rivaroxabannal kezelték. A SARS-CoV-2 fertőzés előtt egészséges, jól működő és sportos egyén volt.
A klinikánkon, 3 hónappal az akut fertőzés után végzett kiindulási kiértékelés magában foglalta az agy mágneses rezonancia képalkotását (MRI) perfúziós és diffúziós tenzoros képalkotással (DTI), számítógépes neurokognitív értékelést, kardiopulmonális terhelési tesztet (CPET) és tüdőfunkciós teszteket. .
Kiinduláskor a páciens testmozgás következtében fellépő légszomjra, valamint memória- és többfeladatos munkavégzési nehézségekre panaszkodott, amelyek COVID-19 betegsége után kezdődtek.
A fizikális és neurológiai vizsgálat normális volt. Az agy MRI-értékelése csökkent perfúziót mutatott, ami korrelált a kognitív hanyatlással, amint azt alább részletezzük. Hiperbár oxigénterápiára (HBOT) utalták, amely 60 ülésből állt, heti 5 napon. Minden alkalom 90 perces 100%-os oxigénnek való expozíciót tartalmazott 2 atmoszféra abszolút nyomáson, 5 percenként 20 perces levegőszünetekkel.
A páciens első HBOT-kezelését 19. április 2021-én kezdték meg, és 15. július 2021-én fejezték be jelentős mellékhatások nélkül. Az első öt alkalom után arról számolt be, hogy a légzése javulni kezdett, és edzés után már nem fáj az izom. 15 alkalom után kevesebb fáradtságot tapasztalt, és javult korábbi alacsony energiája. 20 alkalom után észrevette, hogy légzési és testmozgási kapacitása visszatért a SARS-CoV-2 fertőzés előtti képességeihez, és visszatért a futó hegyi ösvényekhez. Ezenkívül megjegyezte, hogy memóriája és többfeladatos képessége visszatért a COVID-19 előtti szintre.
A kiindulási agyi MRI a HBOT előtt két kis jelelváltozást mutatott ki a jobb és bal oldali parietális régióban, ami korai kisérbetegségre utal. Ezenkívül globálisan csökkent az agy perfúziója. Amint azt az 1. ábra és 1. táblázat részletezi, a HBOT utáni újraértékelés (4 héttel az utolsó HBOT után, hogy elkerüljük a lehetséges köztes hatásokat) az agy perfúziójának jelentős növekedését tárta fel. A 2. és 3. táblázat az agy mikroszerkezetének MRI–DTI-vel kimutatott javulását mutatja be.
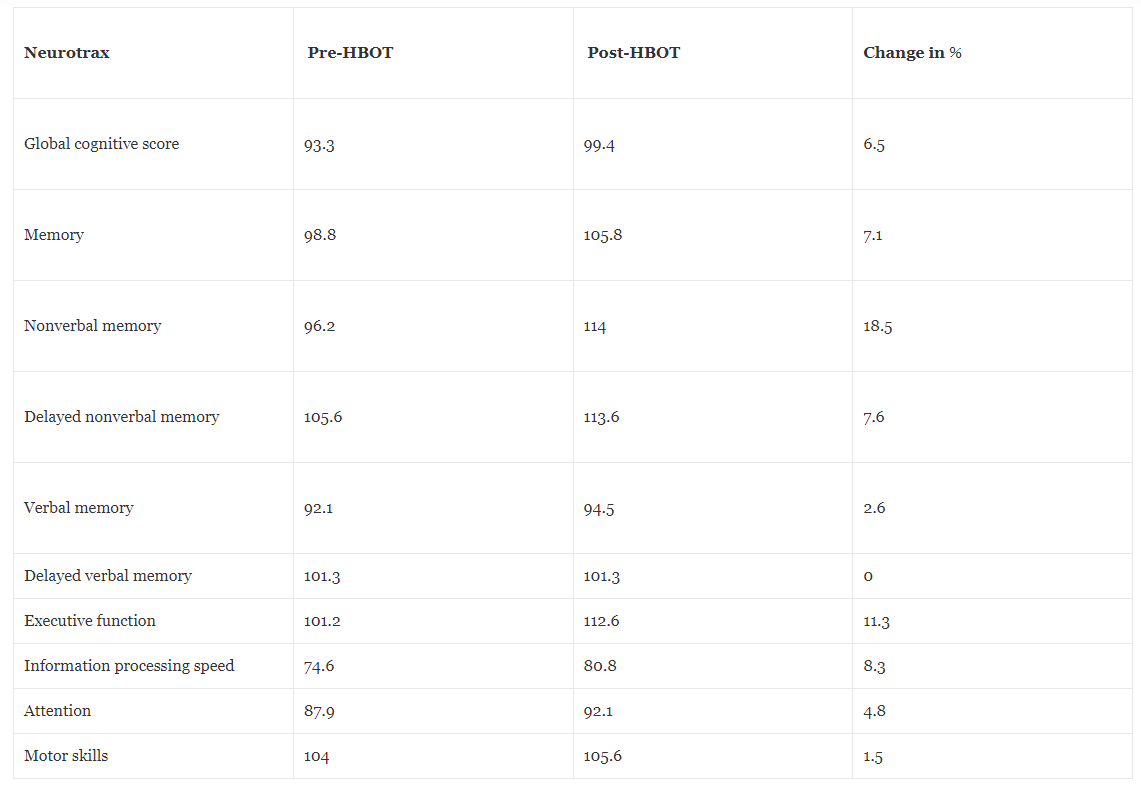
A neurokognitív értékelést NeuroTrax teljes számítógépes tesztelő akkumulátorral végezték az agyműködés különböző aspektusainak mérésére, mint például a memória, az információfeldolgozás sebessége, a figyelem és a végrehajtó funkció, a HBOT előtt és után. A poszt-HBOT neurokognitív tesztek a globális memória jelentős javulását mutatták ki, a legdominánsabb hatással a nonverbális memóriára, a végrehajtó funkciókra, a figyelemre, az információfeldolgozás sebességére, a kognitív rugalmasságra és a többfeladatos munkavégzésre. A 4. táblázat a HBOT előtti és utáni pontszámokat foglalja össze a különböző kognitív tartományokban.
A fizikai teljesítőképességet maximális kardiopulmonális terhelési teszttel (CPET) értékelték, amelyet COSMED futópadon, Boston 5 protokollal végeztek. Az 5. táblázat a HBOT előtti és utáni fiziológiai kiértékelt paramétereket mutatja be. Amint részleteztük, a VO34 max 2%-kal nőtt, 3083-ról 4130 ml/perc-re a HBOT után. A kényszerített vitálkapacitás (FVC) 44%-kal javult 4.76-ról 6.87 literre, a kényszerített kilégzési térfogat (FEV) 23%-kal, 3.87-ről 4.76 literre, a csúcsteljesítmény mérése (PEF) pedig 20.2%-kal, 10.17-ről 12.22 literre másodpercenként .
Miután a HBOT utáni értékelése végén megkapta a teljes körű tájékoztatást, a beteg tájékozott beleegyezést írt alá, amely lehetővé tette orvosi információinak közzétételét.
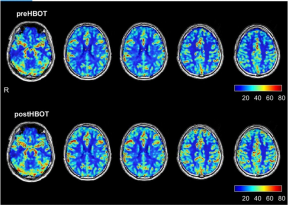
Ábra 1Agy perfúziós mágneses rezonancia képalkotás hiperbár oxigénterápia előtt és után. A felső sor az agyi perfúziót mutatja 3 hónappal az akut fertőzés után, a hiperbár oxigénterápia előtt. Az alsó sor a perfúziós mágneses rezonancia képalkotást mutatja, amelyet a hiperbár oxigénterápiás protokoll befejezése után végeztek.
Táblázat 1Az agy vérkeringése megváltozik a hiperbár oxigénterápia előtt és után
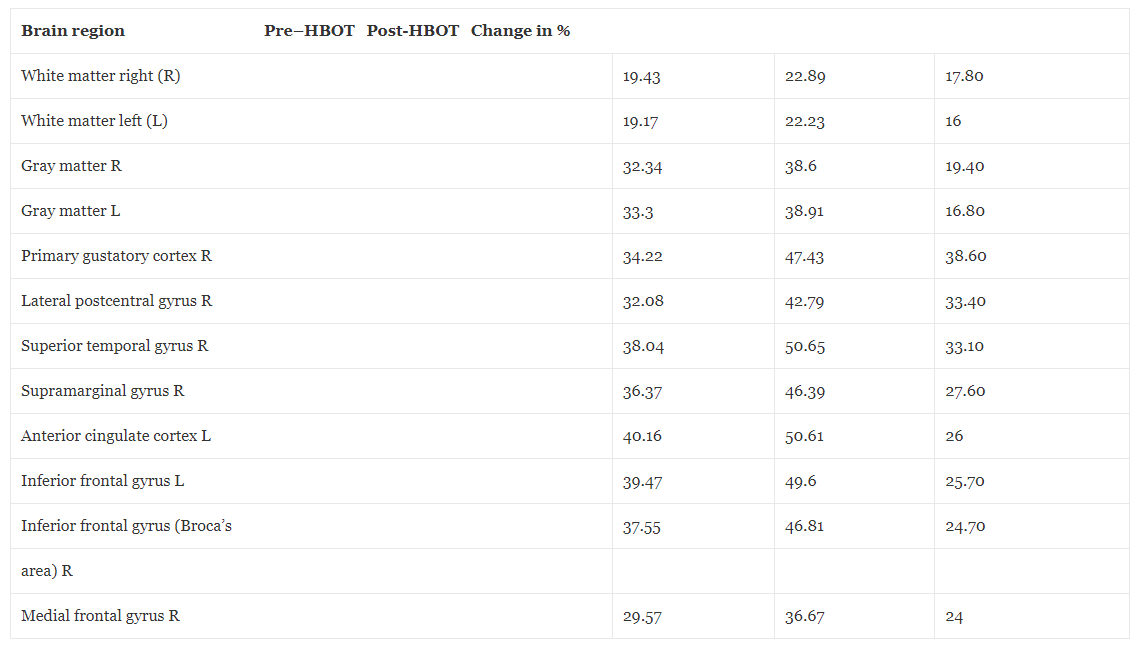
Megbeszélés és következtetések
Itt egy hosszú COVID-ban szenvedő, kognitív és kardiorespirációs tünetekkel járó, HBOT által sikeresen kezelt beteg első esetét közöljük. A kezelést követően jelentős javulást mutatott az agy perfúziójában, a fehérállomány agyi mikrostruktúrájában, valamint a kognitív és kardiopulmonáris funkciójában. Az esetjelentés azt mutatja, hogy a HBOT potenciálisan alkalmazható olyan hosszú COVID-ban szenvedő betegek kezelésére, akik szüntelenül kognitív és fizikai funkcionális hanyatlásban szenvednek.
A hipoxia fontos szerepet játszik a hosszú COVID patofiziológiájában. Szisztémás hipoxiát okozhat a tüdő károsodása, és szervi eredetű hypoxia alakulhat ki az érrendszeri károsodás miatt. Tartós tüdőfunkció
Táblázat 2Mágneses rezonancia képalkotás – diffúziós tenzor képalkotás frakcionált anizotrópia változások a hiperbár oxigénterápia előtt és után

A frakcionált anizotrópia (FA) egy olyan mérőszám, amelyet a fehérállomány szálak integritásának, irányultságának és sorrendjének értékelésére használnak. Az FA magasabb értéke jobb szervezettséget jelez. DTI diffúziós tenzor képalkotás
Táblázat 3Mágneses rezonancia képalkotás – diffúziós tenzor képalkotás átlagos diffúziós változások a hiperbár oxigénterápia előtt és után
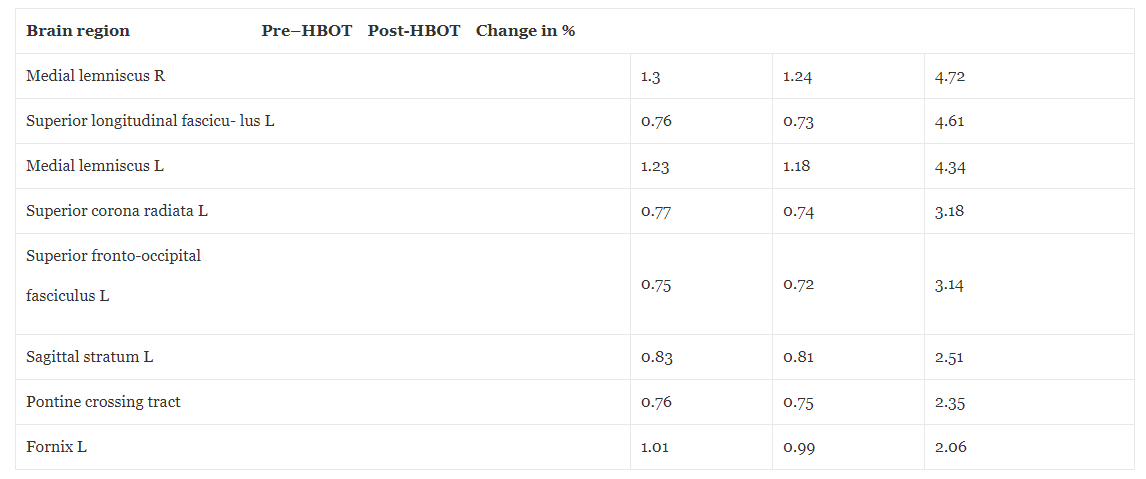
Az átlagos difuzivitás (MD) a fehérállomány fbersűrűségének értékelésére használt mérték. Az MD alacsonyabb értéke nagyobb sűrűséget jelez. DTI diffúziós tenzor képalkotás.
Táblázat 4Kognitív pontszámok hiperbár oxigénterápia előtt és után
Táblázat 5Élettani paraméterek hiperbár oxigénterápia előtt és után
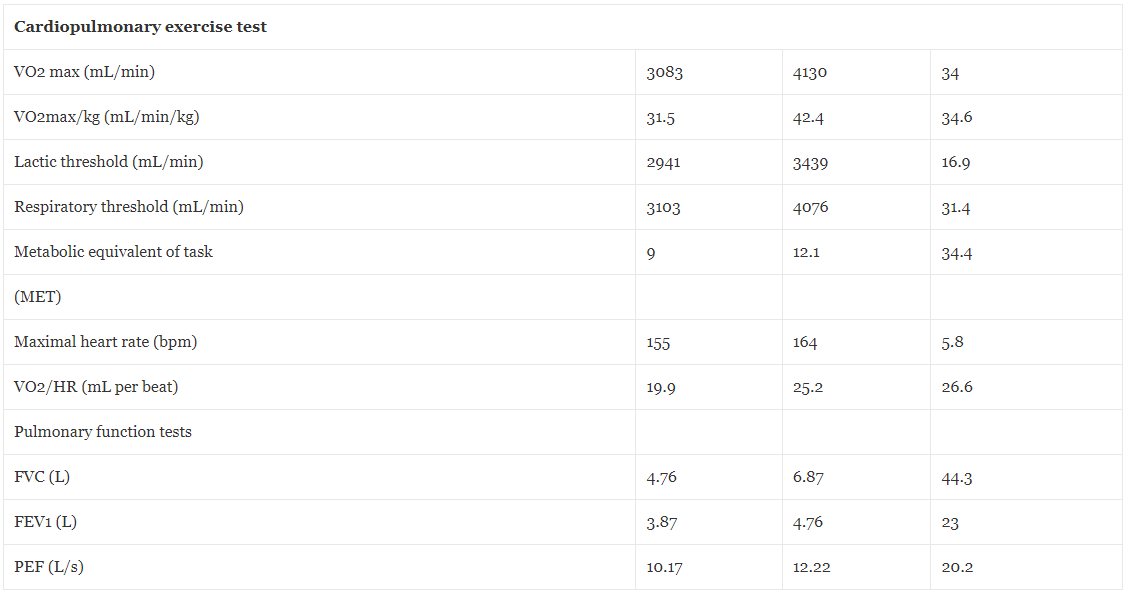
VO2max maximális oxigénfogyasztás mértéke edzés közben, ml/perc milliliter/perc, VO2max/kg edzés közben elfogyasztott oxigén maximális sebessége kilogrammonként, ml/perc/kg milliliter/perc/kg, MET anyagcsere-egyenértéke a feladatnak, bpm szívverések percenként , pulzusonként elfogyasztott oxigén VO2/HR aránya, FVC kényszerített vitálkapacitás, L liter, FEV1 kényszerített kilégzési térfogat, PEF csúcs fow mérés, L/s liter/s.
károsodást észleltek azoknál a betegeknél, akiknek az akut SARS-CoV-2 fertőzés során kiegészítő oxigénre volt szükségük még 6 és 12 hónappal az akut fertőzés után is [6]. Mivel az agy működése és regenerációs képessége érzékeny az oxigénellátás bármely csökkenésére [7], a hosszú távú kognitív hiányosságok korrelálnak a légzési nehézségek leküzdéséhez szükséges oxigén mennyiségével [1]. Ami a szervi eredetű ischaemiát illeti, a COVID-19 endothel károsodást és hiperkoagulációt váltott ki, ami növeli a szívizominfarktus, az ischaemiás stroke és a tüdőembólia magas prevalenciájáért felelős érrendszeri diszfunkció kockázatát [8]. A bemutatott esetben a páciens akut betegsége során 1 hétig tartó, nagy áramlású oxigénnel történő szupportív kezelésre szorult, vagyis szisztémás hipoxiában szenvedett, és ennek következményeként az anoxikus agykárosodás miatti hosszú távú kognitív károsodás kockázata volt. Ezenkívül 6 héttel az akut fertőzés után tüdőembólia alakult ki nála, amely az endothel diszfunkcióra jellemző, és további szisztémás hipoxiával járt. Ezen túlmenően, amint azt az agyi perfúziós MRI kimutatta, mikrovaszkuláris eredetű perfúziós hibái voltak, amelyek korrelálnak neurokognitív hanyatlásával.
A HBOT 100%-os oxigén belélegzését jelenti 1 atmoszféra abszolút (ATA) feletti nyomáson, ezáltal növelve a testszövetekben oldott oxigén mennyiségét. Annak ellenére, hogy a HBOT számos jótékony hatása a szöveti oxigénellátás javulásával magyarázható, ma már nyilvánvaló, hogy a hiperoxia és a túlnyomás együttes hatása oxigén- és nyomásérzékeny géneket is beindít, ami regeneratív folyamat indukcióját eredményezi. folyamatok, beleértve az őssejt-proliferációt és mobilizációt anti-apoptotikus és anti-gyulladásos faktorokkal, angiogenezist és neurogenezist [9–12]. A HBOT még évekkel az akut inzultus után is képes neuroplaszticitást indukálni és javítani a kognitív funkciókat [13]. Hosszú COVID esetén a HBOT javította az agyi véráramlást a hibásan fuzionált agyi régiókba (ami az agy angiogenezisére utal), és javította az agy mikroszerkezetének integritását (ez a neurogenezisre utal). Az agyi képalkotásban kimutatott szignifikáns javulások és a neurokognitív fejlesztések közötti összefüggés azt jelzi, hogy a HBOT jótékony hatásai közül a legtöbb valóban összefügg azzal a képességével, hogy kiváltja az agy diszfunkcionális régióinak neuroplaszticitását.
Kimutatták, hogy a HBOT jótékony hatással van a mitokondriális működésre, amely a megfelelő izomműködés kulcsfontosságú eleme [12]. A HBOT növelheti a szaporodó és differenciálódó szatellitsejtek számát, valamint a regenerálódott izomszövetek számát, és elősegítheti az izomerőt [14]. Bebizonyosodott, hogy az újonnan intermittáló ismételt HBOT protokoll képes javítani a tüdőfunkciót a kilégzési csúcs (PEF) és a force vital kapacitás (FVC) tekintetében [15]. A bemutatott betegnél a cardiopulmonalis rendszer teljesítőképességét kardiopulmonális terhelési teszttel (CPET) és tüdőfunkciós tesztekkel értékelték. A HBOT szignifikáns, 34%-os javulást indukált a maximális oxigénfogyasztási kapacitásban, 34.4%-os javulást a maximális MET-ekben és 16.9%-os növekedést a tejsavas küszöbben. A tüdőfunkció tekintetében az FVC 44.3%-kal, a PEF pedig 20.2%-kal javult. A mérhető javulás korrelált a páciens azon képességével, hogy visszanyerje korábbi magas sportteljesítményét.
Ebben a jelentett esetben a HBOT-kezelést több mint 3 hónappal az akut SARS-CoV-2 fertőzés után kezdték meg. Bár a tünetek a HBOT megkezdéséig fennmaradtak, és a jelentős javulás csak a HBOT megkezdése után kezdődött, lehetséges, hogy a klinikai javulás legalább egy része HBOT nélkül is bekövetkezhetett volna. Azonban a tünetek krónikus jellege után a teljes felépüléssel járó hirtelen jelentős javulás, a HBOT fiziológiai hatásainak megértése, valamint a betegen végzett objektív mérések alátámasztják a kezelés és a tapasztalt javulás közötti kapcsolatot. Mivel ez csak egy esetjelentés, további prospektív klinikai vizsgálatokra van szükség ahhoz, hogy jobban megértsük a HBOOT lehetséges jótékony hatásait a hosszú COVID-ban szenvedő betegek számára.
Összefoglalva, ez a cikk az első olyan esetjelentés, amely azt mutatja, hogy a COVID hosszú ideig kezelhető HBOT-tal. A HBOT jótékony hatása további megvilágításba helyezi ennek a szindrómának a patofiziológiáját. Mivel ez egyetlen esetjelentés, további prospektív, randomizált kontrollvizsgálatokra van szükség a hiperbár oxigénterápia alkalmazásához a hosszú COVID kezelésében.
Rövidítések
HBOT: Hiperbár oxigénterápia; MRI: Mágneses rezonancia képalkotás; DTI: diffúziós tenzoros képalkotás; VO2 max: Az edzés során elfogyasztott oxigén maximális mértéke; CPET: Cardiopulmonalis terhelési teszt; HR: pulzusszám; Bpm: szívverés percenként; FVC: Forced vital kapacitás; FEV1: Kényszerített kilégzési térfogat; PEF: Fow fow csúcsmérés.
Köszönetnyilvánítás
Nem alkalmazható.
Szerzők hozzájárulása
Az AMB, ES, SE és SK elemezte és értelmezte a betegek MRI-vel, perfúzióval és DTI-vel kapcsolatos adatait. Az AMB és az SE elemezte és értelmezte a betegadatokat a kardiopulmonális és tüdőfunkciós vizsgálatokra vonatkozóan. Minden szerző elolvasta és jóváhagyta a végső kéziratot.
Szerzők hozzájárulása
Az AMB, ES, SE és SK elemezte és értelmezte a betegek MRI-vel, perfúzióval és DTI-vel kapcsolatos adatait. Az AMB és az SE elemezte és értelmezte a betegadatokat a kardiopulmonális és tüdőfunkciós vizsgálatokra vonatkozóan. Minden szerző elolvasta és jóváhagyta a végső kéziratot.
Az adatok és az anyagok elérhetősége
A tanulmány során generált vagy elemzett összes adat megtalálható ebben a publikált cikkben.
nyilatkozatok
Etikai jóváhagyás és részvételi hozzájárulás
Nem alkalmazható.
Beleegyezés a közzétételhez
A beteg írásos beleegyezését kapta a jelen esetjelentés és a kísérő képek közzétételéhez. Az írásbeli hozzájárulás egy példánya a folyóirat főszerkesztője számára elérhető.
Érdekütközés
Az AMB, a ZW, az SK, az MG és az UQ az AVIV Clinics-nek dolgozik. ES az AVIV Scientifc LTD-nek dolgozik. SE az AVIV Scientifc LTD társalapítója és részvényese.
Beérkezett: 11. október 2021. Elfogadás: 21. január 2022., Online közzététel: 15. február 2022.
Referenciák
Lopez-Leon S és mtsai. A COVID-50 több mint 19 hosszú távú hatása: szisztematikus áttekintés és metaanalízis. Sci Rep. 2021;11(1):16144.
LeviM és mtsai. Alvadási rendellenességek és trombózis COVID-19-ben szenvedő betegeknél. Lancet Haematol. 2020;7(6):e438–40.
MahmudpourM és mtsai. COVID-19 citokinvihar: a gyulladás haragja. Citokin. 2020; 133: 155151.
LiB és mtsai. Agy-immun kölcsönhatások perinatális hipoxiás-ischaemiás agysérülésben. Prog Neurobiol. 2017;159:50–68.
ShapiraR és mtsai. A hiperbár oxigénterápia javítja a 3xTg-AD egérmodell patofiziológiáját azáltal, hogy enyhíti a neuroinfammációt. Neurobiol öregedés. 2018;62:105–19.
HuangL és mtsai. 1 éves eredmények kórházi túlélőknél COVID-19-ben: longitudinális kohorszvizsgálat. Gerely. 2021;398(10302):747–58.
HadannyA, Efrati S. Oxigén – korlátozó tényező az agy helyreállításában. Crit Care. 2015;19:307.
KatsoularisI és mtsai. Az akut szívinfarktus és az ischaemiás stroke kockázata a COVID-19-et követően Svédországban: önkontrollos esetsorozat és megfelelő kohorszvizsgálat. Gerely. 2021;398(10300):599–607.
Pena-VillalobosI és mtsai. A hiperbár oxigén növeli az őssejt-proliferációt, az angiogenezist és a WJ-MSC-k sebgyógyító képességét diabéteszes egerekben. Front Physiol. 2018;9:995.
CabigasBP és mtsai. Hiperoxiás és hiperbár okozta kardioprotekció: a nitrogén-monoxid szintáz szerepe 3. Cardiovasc Res. 2006;72(1):143–51.
GregorevicP, Lynch GS, Williams DA. A hiperbár oxigén modulálja az antioxidáns enzimek aktivitását a patkány vázizmokban. Eur J Appl Physiol. 2001;86(1):24–7.
ZhouZ és mtsai. A mitokondriális funkció védelme és a kognitív helyreállítás javítása hiperbár oxigénnel kezelt patkányokban oldalsó folyadék-ütősérülést követően. J Neurosurg. 2007;106(4):687–94.
HadannyA és mtsai. A hiperbár oxigénterápia javítja a stroke utáni betegek neurokognitív funkcióit – retrospektív elemzés. Restor Neurol Neurosci. 2020;38(1):93–107.
HorieM és mtsai. A szatellitsejtek differenciálódásának és funkcionális helyreállításának fokozása sérült vázizomzatban hiperbár oxigénkezeléssel. J Appl Physiol. 2014;116(2):149–55.
HadannyA és mtsai. A hiperbár oxigénterápia hatása a tüdőfunkciókra: prospektív kohorsz vizsgálat. BMC Pulm Med. 2019;19(1):148.
A kiadó megjegyzése
A Springer Nature semleges marad a közzétett térképeken szereplő joghatósági igényeket és az intézményi kapcsolatokat illetően.






