Hyperbare zuurstofbehandeling voor langdurige coronavirusziekte-19: een casusrapport
Achtergrond
De pandemie van de coronavirusziekte 2019 (COVID-19) heeft geresulteerd in een groeiende populatie van individuen die een breed scala aan langdurige symptomen ervaren na herstel van de acute ziekte, waarnaar wordt verwezen met verschillende termen, waaronder ‘post-COVID-aandoeningen’ en ‘langdurige symptomen’. COVID." De vijf meest voorkomende symptomen die post-COVID worden herkend, zijn vermoeidheid (58%), hoofdpijn (44%), cognitieve stoornissen (27%), haaruitval (25%) en kortademigheid (24%) [1]. Twee belangrijke biologische gevolgen van COVID-19 spelen een rol in de pathogenese van langdurige COVID. De eerste is de toestand van hypercoagulabiliteit die wordt gekenmerkt door een verhoogd risico op occlusie van kleine en grote bloedvaten [2]. De tweede is een ongecontroleerde, voortdurende ontstekingsreactie [3]. Micro-infarcten en neuro-infammatie zijn belangrijke oorzaken van hersenhypoxie en kunnen verantwoordelijk zijn voor de chronische aanhoudende neurocognitieve achteruitgang bij patiënten met langdurige COVID [4]. Een van de opties om hypoxie om te keren, neuro-ontsteking te verminderen en neuroplasticiteit te induceren is hyperbare zuurstoftherapie (HBOT) [5].
In dit artikel presenteren we het eerste casusrapport van een voorheen gezond, atletisch individu dat leed aan een langdurig post-COVID-syndroom en met succes werd behandeld met HBOT.
Case presentatie
Een 55-jarige, voorheen gezonde blanke man die leed aan aanhoudende, aanhoudende symptomen van langdurige COVID, bezocht onze kliniek voor evaluatie. De klinische presentatie omvatte geheugenproblemen, verslechtering van het multitaskingvermogen, vermoeidheid, weinig energie, kortademigheid en verminderde fysieke fitheid, die allemaal begonnen na een acute SARS-CoV-2-infectie die drie maanden eerder werd gediagnosticeerd. Op 3 januari 21 kreeg hij aanvankelijk hoge koorts zonder pijn op de borst, hoesten of kortademigheid. Op 2021 januari 30 werd hij in het ziekenhuis opgenomen vanwege uitdroging en bij hem werd de diagnose COVID-2021 gesteld door middel van omgekeerde transcriptiepolymerasekettingreactie ( RT-PCR). Tijdens het verblijf in het ziekenhuis ontwikkelde hij een acuut ademhalingssyndroom als gevolg van een pneumonitis en had hij een ondersteunende behandeling met zuurstof met een hoog zuurstofdebiet nodig gedurende een week. Hij werd op 19 februari 1 uit het ziekenhuis ontslagen. Bij ontslag was hij stabiel met normale zuurstof en bij lichamelijk onderzoek werden geen neurologische afwijkingen opgemerkt. Bovendien kreeg hij zes weken nadat de diagnose COVID-16 was gesteld een longembolie en werd hij behandeld met rivaroxaban. Vóór de SARS-CoV-2021-infectie was hij een gezond, goed functionerend en atletisch individu.
De basislijnevaluatie die in onze kliniek werd uitgevoerd, drie maanden na de acute infectie, omvatte magnetische resonantiebeeldvorming (MRI) van de hersenen met perfusie- en diffusietensorbeeldvorming (DTI), computergestuurde neurocognitieve evaluatie, cardiopulmonale inspanningstest (CPET) en longfunctietesten. .
Bij aanvang klaagde de patiënt over kortademigheid bij inspanning en over problemen met het geheugen en multitasken die begonnen na zijn ziekte door COVID-19.
Het lichamelijk en neurologisch onderzoek was normaal. MRI-evaluatie van de hersenen toonde een verminderde perfusie aan die correleerde met de cognitieve achteruitgang, zoals hieronder beschreven. Hij werd verwezen naar hyperbare zuurstoftherapie (HBOT), die 60 sessies omvatte, 5 dagen per week. Elke sessie omvatte blootstelling aan 90 minuten 100% zuurstof bij 2 atmosfeer absoluut, met elke 5 minuten een luchtpauze van 20 minuten.
De patiënt begon zijn eerste HBOT op 19 april 2021 en eindigde op 15 juli 2021 zonder noemenswaardige bijwerkingen. Na de eerste vijf sessies meldde hij dat zijn ademhaling begon te verbeteren en dat hij na het sporten geen spierpijn meer had. Na 15 sessies merkte hij minder vermoeidheid op en een verbetering van zijn eerdere lage energieniveau. Na twintig sessies merkte hij dat zijn ademhalings- en inspanningsvermogen waren teruggekeerd naar het niveau van vóór de SARS-CoV-20-infectie, en keerde hij terug naar het rennen van bergpaden. Bovendien merkte hij op dat zijn geheugen en multitaskingvermogen terugkeerden naar het niveau van vóór COVID-2.
De basislijn MRI van de hersenen, voorafgaand aan de HBOT, toonde twee kleine foci van signaalveranderingen in de rechter en linker pariëtale regio's, wat wijst op vroege ziekte van de kleine bloedvaten. Bovendien was er een globale afname van de hersenperfusie. Zoals gedetailleerd weergegeven in figuur 1 en tabel 1 onthulde herevaluatie na HBOT (vier weken na de laatste HBOT uitgevoerd om elk mogelijk tusseneffect te vermijden) een significante toename van de hersenperfusie. Tabellen 4 en 2 presenteren de verbeteringen in de hersenmicrostructuur zoals aangetoond door MRI-DTI.
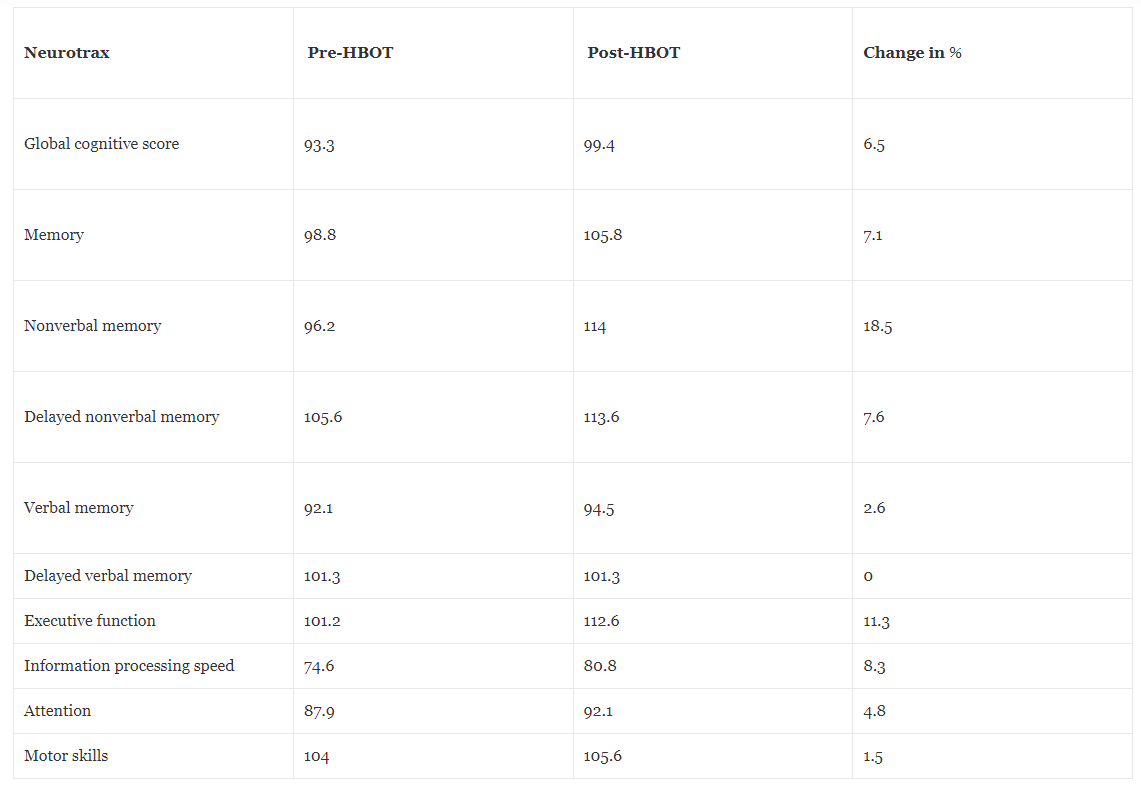
Neurocognitieve beoordeling werd uitgevoerd met behulp van de volledige geautomatiseerde testbatterij van NeuroTrax om verschillende aspecten van de hersenfunctie te meten, zoals geheugen, snelheid van informatieverwerking, aandacht en uitvoerende functies, zowel voor als na HBOT. De post-HBOT-neurocognitieve tests lieten een significante verbetering zien in het mondiale geheugen, met als meest dominante effect het non-verbale geheugen, de executieve functies, de aandacht, de snelheid van de informatieverwerking, de cognitieve flexibiliteit en het multitasken. Tabel 4 vat de pre- en post-HBOT-scores in de verschillende cognitieve domeinen samen.
De fysieke capaciteit werd geëvalueerd door middel van een maximale cardiopulmonale inspanningstest (CPET), uitgevoerd op een COSMED-loopband met behulp van het Boston 5-protocol. Tabel 5 presenteert de pre- en post-HBOT fysiologisch geëvalueerde parameters. Zoals gedetailleerd was er na HBOT een stijging van 34% in de VO2 max van 3083 naar 4130 ml per minuut. De geforceerde vitale capaciteit (FVC) verbeterde met 44% van 4.76 naar 6.87 l, het geforceerde uitademingsvolume (FEV) met 23% van 3.87 naar 4.76 l, en de piekstroommeting (PEF) met 20.2% van 10.17 naar 12.22 l per seconde .
Nadat hij aan het einde van zijn post-HBOT-evaluatie volledige informatie had ontvangen, ondertekende de patiënt een geïnformeerde toestemming die publicatie van zijn medische informatie mogelijk maakte.
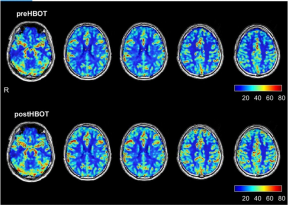
Fig 1Magnetische resonantiebeeldvorming van hersenperfusie voor en na hyperbare zuurstoftherapie. De bovenste rij vertegenwoordigt hersenperfusie 3 maanden na de acute infectie, vóór hyperbare zuurstoftherapie. De onderste rij geeft de perfusie-magnetische resonantiebeeldvorming weer die is uitgevoerd na voltooiing van het hyperbare zuurstoftherapieprotocol.
Tabel 1De bloedstroom in de hersenen verandert voor en na hyperbare zuurstoftherapie
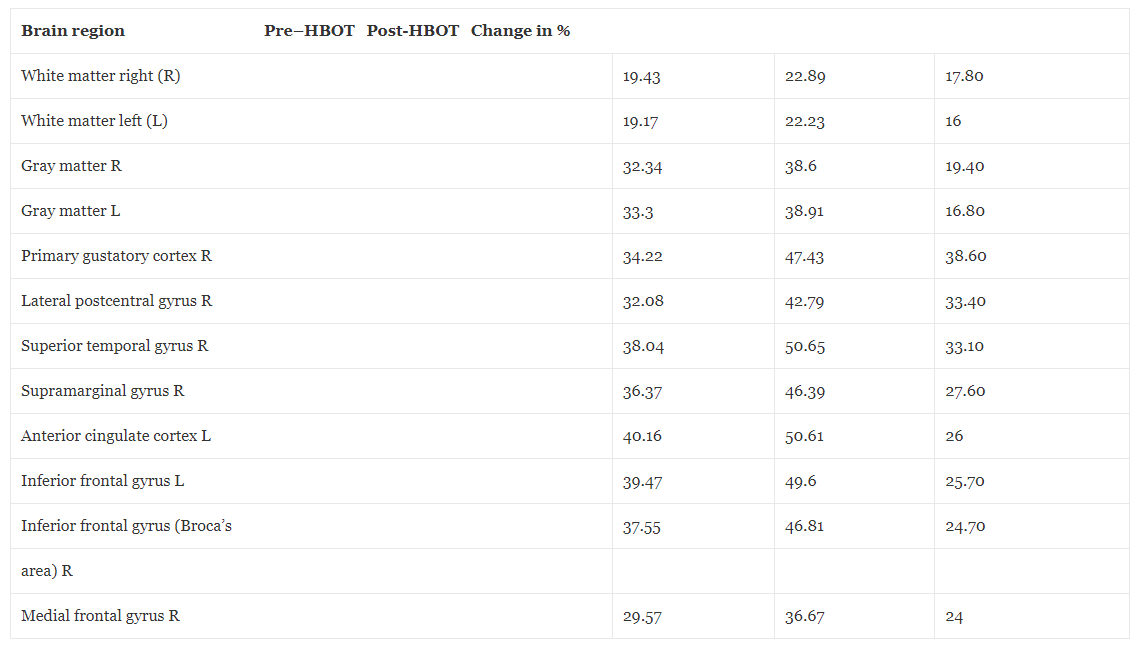
Discussie en conclusies
Hier rapporteren we het eerste geval van een patiënt met langdurige COVID met cognitieve en cardiorespiratoire symptomen die met succes zijn behandeld door HBOT. Na de behandeling vertoonde hij significante verbeteringen in de hersendoorbloeding, de microstructuur van de witte stof in de hersenen en de cognitieve en cardiopulmonale functie. Uit dit casusrapport blijkt dat HBOT potentieel bruikbaar is voor de behandeling van patiënten met langdurige COVID die lijden aan aanhoudende cognitieve en fysieke functionele achteruitgang.
Hypoxie speelt een belangrijke rol in de pathofysiologie van langdurige COVID. Systemische hypoxie kan het gevolg zijn van longschade, en orgaangerelateerde hypoxie kan ontstaan als gevolg van vasculaire schade. Aanhoudende longfunctie
Tabel 2Magnetische resonantie beeldvorming – diffusie tensor beeldvorming fractionele anisotropieveranderingen voor en na hyperbare zuurstoftherapie

Fractionele anisotropie (FA) is een maatstaf die wordt gebruikt om de integriteit, directionaliteit en orde van de witte stofvezels te evalueren. Een hogere waarde van FA duidt op een betere vezelorganisatie. DTI-diffusietensorbeeldvorming
Tabel 3Magnetische resonantiebeeldvorming en diffusietensorbeeldvorming betekenen difusiviteitsveranderingen voor en na hyperbare zuurstoftherapie
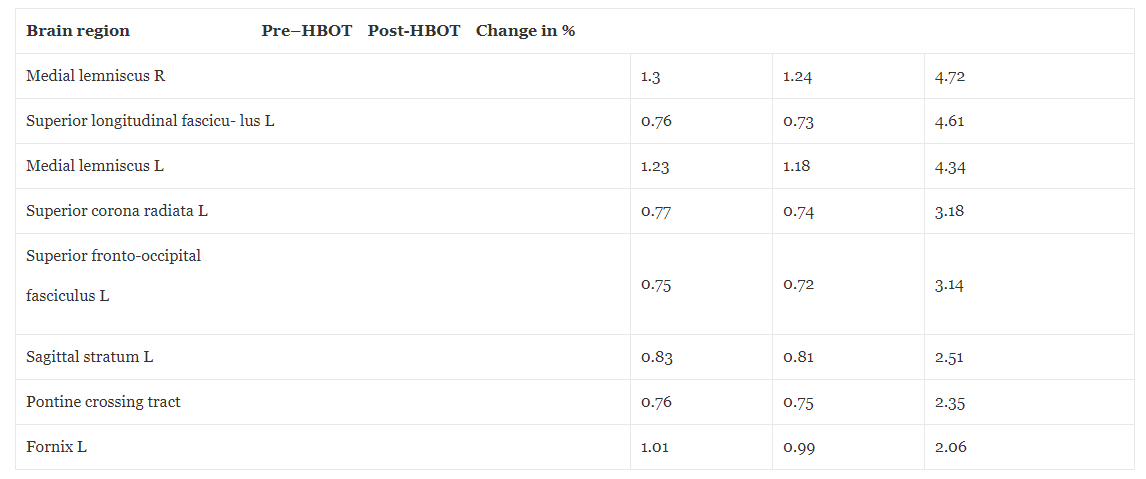
De gemiddelde difusiviteit (MD) is een maatstaf die wordt gebruikt om de vezeldichtheid van de witte stof te evalueren. Een lagere waarde van MD duidt op een hogere dichtheid. DTI-diffusietensorbeeldvorming.
Tabel 4Cognitieve scores voor en na hyperbare zuurstoftherapie
Tabel 5Fysiologische parameters voor en na hyperbare zuurstoftherapie
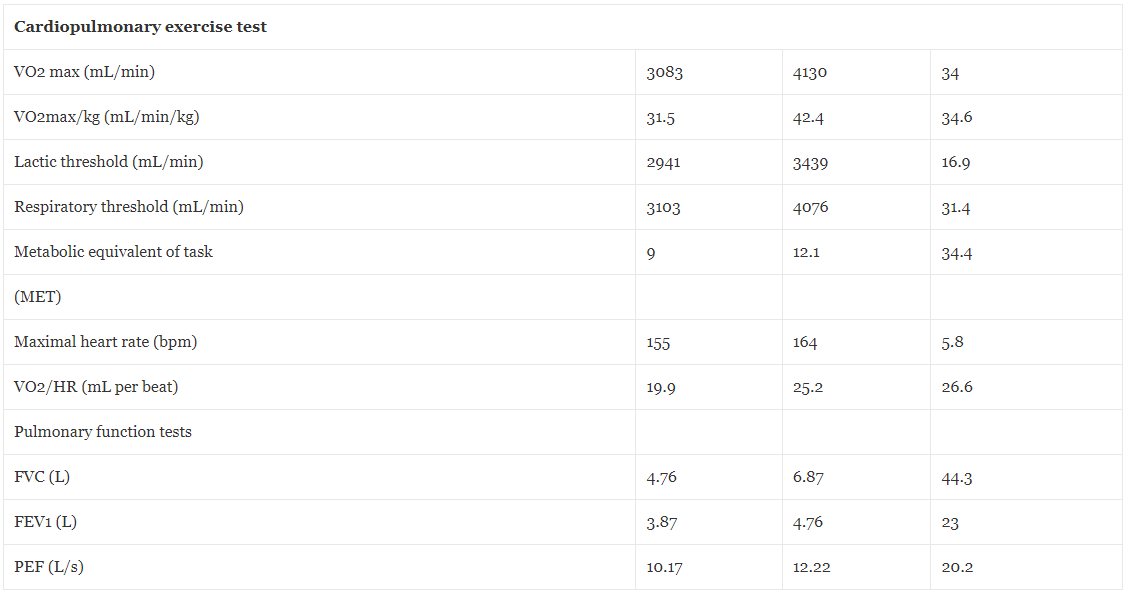
VO2max maximale hoeveelheid zuurstof verbruikt tijdens inspanning, ml/min milliliter per minuut, VO2max/kg maximale hoeveelheid zuurstof verbruikt tijdens inspanning per kilogram, ml/min/kg milliliter per minuut per kilogram, MET metabolisch equivalent van taak, hsm hartslagen per minuut VO2/HR-snelheid van het zuurstofverbruik per hartslag, FVC geforceerde vitale capaciteit, l liter, FEV1 geforceerd uitademingsvolume, PEF-piekstroommeting, l/s liter per seconde.
Er is een stoornis waargenomen bij patiënten die aanvullende zuurstof nodig hadden tijdens een acute SARS-CoV-2-infectie, zelfs 6 en 12 maanden na de acute infectie [6]. Omdat de hersenfunctionaliteit en het regeneratieve vermogen gevoelig zijn voor elke afname van de zuurstoftoevoer [7], correleren cognitieve tekorten op de lange termijn met de hoeveelheid zuurstof die nodig is om de ademhalingsproblemen te overwinnen [1]. Met betrekking tot orgaangerelateerde ischemie veroorzaakte COVID-19 endotheliale schade en hypercoagulatie, wat het risico op vasculaire disfunctie verhoogt, verantwoordelijk voor de hoge prevalentie van hartinfarct, ischemische beroertes en longembolie [8]. In het onderhavige geval had de patiënt tijdens de acute ziekte gedurende één week een ondersteunende behandeling met zuurstof met een hoog zuurstofdebiet nodig, wat inhield dat hij leed aan systemische hypoxie met het daaruit voortvloeiende risico op langdurige cognitieve stoornissen als gevolg van anoxische hersenbeschadiging. Bovendien ontwikkelde hij zes weken na de acute infectie een longembolie, representatief voor de endotheliale disfunctie met extra blootstelling aan systemische hypoxie. Bovendien had hij, zoals aangetoond door de hersenperfusie-MRI, microvasculaire perfusiedefecten die correleerden met zijn neurocognitieve achteruitgang.
Bij HBOT wordt 100% zuurstof ingeademd bij een druk hoger dan 1 atmosfeer absoluut (ATA), waardoor de hoeveelheid opgeloste zuurstof in de lichaamsweefsels toeneemt. Hoewel veel van de heilzame effecten van HBOT kunnen worden verklaard door verbetering van de weefseloxygenatie, wordt nu begrepen dat de gecombineerde werking van hyperoxie en hyperbare druk zowel zuurstof- als drukgevoelige genen activeert, wat resulteert in de inductie van regeneratieve genen. processen waaronder stamcelproliferatie en mobilisatie met anti-apoptotische en ontstekingsremmende factoren, angiogenese en neurogenese [9-12]. HBOT kan neuroplasticiteit veroorzaken en de cognitieve functie zelfs jaren na het acute letsel verbeteren [13]. In het geval van langdurige COVID verbeterde HBOT de cerebrale bloedtoevoer naar de slecht doorbloede hersengebieden (indicatief voor hersenangiogenese) en verbeterde de integriteit van de hersenmicrostructuur (indicatief voor neurogenese). De correlatie tussen de significante verbeteringen die zijn aangetoond bij beeldvorming van de hersenen en de neurocognitieve verbeteringen geeft aan dat de meeste gunstige effecten van HBOT inderdaad verband houden met het vermogen ervan om neuroplasticiteit van de disfunctionele hersengebieden te induceren.
Er is aangetoond dat HBOT gunstige effecten heeft op de mitochondriale functie, een cruciaal element voor een goede spierfunctie [12]. HBOT kan ook het aantal prolifererende en differentiërende satellietcellen vergroten, evenals het aantal geregenereerde spiervezels, en de spierkracht bevorderen [14]. Er werd aangetoond dat het onlangs intermitterende herhaalde HBOT-protocol het potentieel heeft om de longfunctie te verbeteren met betrekking tot de piekuitademingsstroom (PEF) en de vitale capaciteit (FVC) [15]. Bij de gepresenteerde patiënt werd het prestatievermogen van het cardiopulmonale systeem geëvalueerd met behulp van cardiopulmonale inspanningstests (CPET) en longfunctietests. HBOT induceerde een significante verbetering van 34% in de maximale zuurstofconsumptiecapaciteit, een verbetering van 34.4% in de maximale MET's en een toename van 16.9% in de melkzuurdrempel. Wat de longfunctie betreft, was de FVC verbeterd met 44.3% en de PEF met 20.2%. Deze meetbare verbeteringen correleerden met het vermogen van de patiënt om zijn eerdere hoge atletische prestaties te herwinnen.
In dit gemelde geval werd HBOT meer dan drie maanden na de acute SARS-CoV-3-infectie gestart. Hoewel de symptomen aanhielden totdat de HBOT werd gestart en de significante verbetering pas begon nadat de HBOT was gestart, is het mogelijk dat op zijn minst een deel van de klinische verbetering had kunnen plaatsvinden zonder HBOT. De abrupte significante verbetering bij volledig herstel na de chronische aard van de symptomen, ons begrip van de fysiologische effecten van HBOT en de objectieve metingen bij deze patiënt ondersteunen echter de relatie tussen de behandeling en de waargenomen verbeteringen. Omdat dit slechts een casusrapport is, zijn verdere prospectieve klinische onderzoeken nodig om een beter inzicht te krijgen in de potentiële gunstige effecten van HBOOT voor patiënten met langdurige COVID.
Samenvattend is dit artikel het eerste casusrapport dat aantoont dat langdurige COVID kan worden behandeld met HBOT. Het gunstige effect van HBOT werpt extra licht op de pathofysiologie van dit syndroom. Omdat dit een enkel gevalsrapport betreft, zijn verdere prospectieve gerandomiseerde controlestudies nodig voor het gebruik van hyperbare zuurstoftherapie bij de behandeling van langdurige COVID.
Afkortingen
HBOT: Hyperbare zuurstoftherapie; MRI: magnetische resonantiebeeldvorming; DTI: Diffusietensorbeeldvorming; VO2 max: maximale hoeveelheid zuurstof die wordt verbruikt tijdens inspanning; CPET: Cardiopulmonale inspanningstest; HR: hartslag; Bpm: hartslagen per minuut; FVC: Geforceerde vitale capaciteit; FEV1: geforceerd uitademingsvolume; PEF: Piekstroommeting.
Danksagung
Niet toepasbaar.
Bijdragen van auteurs
AMB, ES, SE en SK analyseerden en interpreteerden de patiëntgegevens met betrekking tot de MRI, perfusie en DTI. AMB en SE analyseerden en interpreteerden de patiëntgegevens met betrekking tot de hart- en longfunctietesten. Alle auteurs hebben het definitieve manuscript gelezen en goedgekeurd.
Bijdragen van auteurs
AMB, ES, SE en SK analyseerden en interpreteerden de patiëntgegevens met betrekking tot de MRI, perfusie en DTI. AMB en SE analyseerden en interpreteerden de patiëntgegevens met betrekking tot de hart- en longfunctietesten. Alle auteurs hebben het definitieve manuscript gelezen en goedgekeurd.
Beschikbaarheid van gegevens en materialen
Alle gegevens die tijdens dit onderzoek zijn gegenereerd of geanalyseerd, zijn opgenomen in dit gepubliceerde artikel.
verklaringen
Goedkeuring van ethiek en toestemming om deel te nemen
Niet toepasbaar.
Toestemming voor publicatie
Er werd schriftelijke geïnformeerde toestemming van de patiënt verkregen voor publicatie van dit casusrapport en eventuele bijbehorende afbeeldingen. Een kopie van de schriftelijke toestemming ligt ter beoordeling bij de hoofdredacteur van dit tijdschrift.
Tegenstrijdige belangen
AMB, ZW, SK, MG en UQ werken voor AVIV Clinics. ES werkt voor AVIV Scientifc LTD. SE is medeoprichter en aandeelhouder van AVIV Scientifc LTD.
Ontvangen: 11 oktober 2021 Geaccepteerd: 21 januari 2022, Online gepubliceerd: 15 februari 2022
Referenties
Lopez-Leon S, et al. Meer dan 50 langetermijneffecten van COVID-19: een systematische review en meta-analyse. Sci Rep. 2021;11(1):16144.
LeviM, et al. Stollingsafwijkingen en trombose bij patiënten met COVID-19. Lancet Haematol. 2020;7(6):e438–40.
MahmudpourM, et al. COVID-19 cytokinestorm: de woede van schande. Cytokine. 2020;133: 155151.
LiB, et al. Hersen-immuuninteracties bij perinataal hypoxisch-ischemisch hersenletsel. Prog Neurobiol. 2017; 159: 50–68.
ShapiraR, et al. Hyperbare zuurstoftherapie verbetert de pathofysiologie van het 3xTg-AD-muismodel door neuro-infammatie te verminderen. Neurobiol veroudering. 2018;62:105–19.
HuangL, et al. Resultaten van één jaar bij ziekenhuisoverlevenden met COVID-1: een longitudinale cohortstudie. Lancet. 19;2021(398):10302–747.
HadannyA, Efrati S. Zuurstof – een beperkende factor voor hersenherstel. Kritiek zorg. 2015;19:307.
KatsoularisI, et al. Risico op acuut hartinfarct en ischemische beroerte na COVID-19 in Zweden: een zelfgecontroleerde casusreeks en gematchte cohortstudie. Lancet. 2021;398(10300):599–607.
Pena-VillalobosI, et al. Hyperbare zuurstof verhoogt de proliferatie van stamcellen, angiogenese en wondhelend vermogen van WJ-MSC's bij diabetische muizen. Voorste fysiol. 2018;9:995.
CabigasBP, et al. Hyperoxische en hyperbare geïnduceerde cardioprotectie: rol van stikstofoxidesynthase 3. Cardiovasc Res. 2006;72(1):143–51.
GregorevićP, Lynch GS, Williams DA. Hyperbare zuurstof moduleert de antioxiderende enzymactiviteit in de skeletspieren van ratten. Eur J Appl Fysiol. 2001;86(1):24–7.
ZhouZ, et al. Bescherming van de mitochondriale functie en verbetering van het cognitieve herstel bij ratten die werden behandeld met hyperbare zuurstof na lateraal vloeistof-percussieletsel. J Neurochirurg. 2007;106(4):687–94.
HadannyA, et al. Hyperbare zuurstoftherapie verbetert de neurocognitieve functies van patiënten na een beroerte – een retrospectieve analyse. Herstel Neurol Neurosci. 2020;38(1):93–107.
HorieM, et al. Verbetering van satellietceldifferentiatie en functioneel herstel in gewonde skeletspieren door hyperbare zuurstofbehandeling. J Appl. Fysiol. 2014;116(2):149–55.
HadannyA, et al. Hyperbare zuurstoftherapie-effecten op longfuncties: een prospectieve cohortstudie. BMC Pulm Med. 2019;19(1):148.
Opmerking van de uitgever
Springer Nature blijft neutraal met betrekking tot jurisdictieclaims in gepubliceerde kaarten en institutionele verbanden.






